的蛋白质的结构决定了它与其他分子相互作用的方式以及它在我们体内的作用。疏水和氢键变异体的实验研究使我们能够了解蛋白质的结构和蛋白质的稳定性,这对蛋白质行为的研究都是必不可少的。
蛋白质:我们身体里的工人
科学家们在20世纪30年代开始对蛋白质结构感兴趣,从那时起,蛋白质就成为了科学研究最多的课题之一(1)。蛋白质是折叠多肽,构成了细胞中大部分的生物分子,并负责许多酶的功能,如分子的运输、细胞结构、DNA复制、细胞分裂和对刺激的反应——这只是几个例子。这种广泛的功能,加上许多其他的功能,是人们如此仔细地研究蛋白质结构的原因。
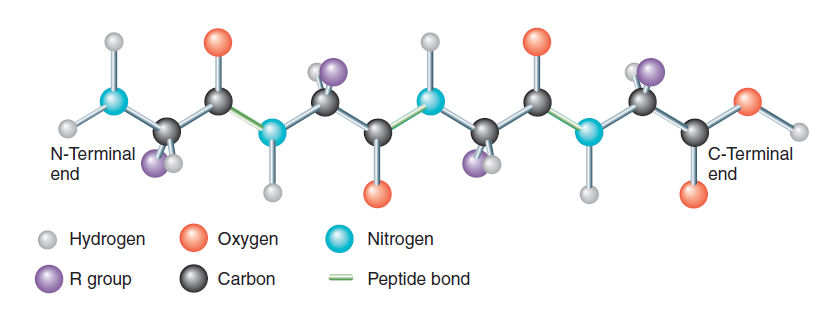
蛋白质是氨基酸链,合成它们的信息编码在我们的基因中。特定蛋白质链中的氨基酸序列与每种蛋白质在有机体中所扮演的角色有关。
负责蛋白质结构的力
除了一些特殊的蛋白质外,每一种蛋白质一般都折叠成一个三维球状结构这负责它将在生物体中执行的活动(2,3)。几种力量共同作用,使蛋白质具有特定的结构,并有助于它们的稳定性。今天的蛋白质分析技术正在提供突破性的成果,使科学家能够更深入地探索这些复杂的大分子。
氢和疏水相互作用在维持中起着非常积极的作用蛋白质的稳定性(4,5).在氢相互作用中,多肽中的氮原子和氧原子形成氢键,有助于蛋白质的三维结构的配置(6)。另一方面,一旦蛋白质折叠,疏水相互作用就会发生,疏水内部的非极性氨基酸不再与水接触(7)。
其他因素也在起作用。在蛋白质的内部空间很小,这导致了伦敦色散力的结构增强,伦敦色散力是紧密包装的结果(7)*。蛋白质结构也可以通过两个含有硫成分的氨基酸之间的二硫键来增强。此外,多肽可以包含带负电残基的氨基酸,如谷氨酰胺和天冬氨酸,以及基本氨基酸,如组氨酸、赖氨酸和精氨酸。这就在蛋白质中产生了带相反电荷的不同区域,并通过静电作用相互吸引。这些力被称为盐桥(8)。
范德华力是决定蛋白质稳定性的最不重要的力。它们是由组成氨基酸的一些原子的电子云形成的瞬态偶极子的吸引力产生的。它们是微弱的,但由于它们的数量相关。
引用:
- Mirsky AE, Pauling L.(1936)原生、变性和凝固蛋白质的结构。美国国家科学研究院1936;22:439-47。
- 十五年的蛋白质内在失调:生物学仍在等待物理学。蛋白质科学2013年6月;22(6): 693 - 724。2013年4月2日在线出版。doi: 10.1002 / pro.2261
- 王晓燕,王晓燕,王晓燕。多蛋白复合物的结构表征。2014年7月8日;22日(7):1063 - 1070。doi: 10.1016 / j.str.2014.05.005
- Shirley BA, Stanssens P, Hahn U, Pace CN。贡献对核糖核酸酶T1构象稳定性的影响。生物化学。1992;31:725-32。
- 力稳定蛋白的研究进展。FEBS Lett. 2014年6月27日;588(14): 2177 - 2184。2014年5月17日在线发布。doi: 10.1016 / j.febslet.2014.05.006
- 天然、变性和凝固蛋白质的结构。美国国家科学学报1936;22:439-47。
- 小GJ,玫瑰GD。蛋白质中氨基酸亚群的疏水性。蛋白质。1990;8:6-13。
- Donald J., Kulp D., despo W.盐桥:几何特异性,可设计的相互作用。蛋白质。2011年3月;79(3): 898 - 915。2011年1月5日在线出版。doi: 10.1002 / prot.22927









